Factores clínico histológicos y pronóstico del tumor phyllodes de mama, análisis de datos de nuestra institución
Rev Venez Oncol 2014;26(1):9-15
Por: Luis Ricardo Galvis C, Efrén Bolívar A, Ángela Ruiz, Alfonso Cáceres, Emperatriz Agüero, Rafael Delgado, Carmen Luces, George Oblitas.
Servicio de Patología Mamaria, Servicio de Anatomía Patológica, Instituto de Oncología “Dr. Luis Razetti”, Caracas, Venezuela.
Trabajo Ganador del Premio Dr. Elpidio Serra G. 2013.
Resumen
OBJETIVO: Determinar la supervivencia libre de recurrencia y la supervivencia global en pacientes con tumor phyllodes así como documentar las características clínico patológicas de una serie de casos reportados en nuestro centro. MÉTODO: Se evaluaron los datos demográficos, clínicos e histopatológicos de 42 pacientes con tumor phyllodes desde el año 2001 a abril 2011 que acudieron a nuestra institución. Las variables patológicas y quirúrgicas fueron investigadas como predictores de recurrencia y supervivencia global RESULTADOS: Histológicamente se reportaron 42 tumores phyllodes; 23 fueron benignos, 11 borderline y 8 malignos. La media de seguimiento de estos pacientes fue de 82 meses, entre un rango de 9 a 163 meses, en los que se reportaron 6 casos de recurrencia, 3 en tumores benignos (13 %), 1 en borderline (9 %) y 2 de tumores malignos (22,2 %). En cuanto a la supervivencia global según el grado histológico del tumor, obtuvimos un valor de 88,1 %. La supervivencia libre de enfermedad a 5 años, con un valor de 85,7 % (P=0,551) DISCUSIÓN: Los factores clínico patológicos descritos como hipercelularidad estromal, las atipias, mitosis y la naturaleza de los márgenes del tumor, permite su caracterización y no proporciona al paciente mejor supervivencia global ni libre de recurrencia, siendo una herramienta importante al especialista para el manejo de las pacientes con tumores phyllodes.
PALABRAS CLAVE: Tumor, phyllodes, mama, cirugía, supervivencia
Introducción
El tumor phyllodes es una lesión fibroepitelial, bifásica e infrecuente en la mama (1), descrito por primera vez por Johannes Müller en 1838 (2) como un tumor denominado cistosarcoma phyllodes (3). La edad media de presentación es de 45 años, pero se han reportado casos menores a 25 años, en contraste con la distribución por edades del fibroadenoma (4). Ellos representan menos del 0,3 % a 0,9 % (5-9) de todos los tumores de mama y el 2 % al 3 % de las neoplasias fibroepiteliales de la mama (1, 5).
Macroscópicamente los tumores phyllodes, son típicamente redondeados, relativamente bien circunscritos y firmes, con el complejo areola pezón adelgazado sin fijación directa a la piel y al corte la superficie es sólida de color blanco grisáceo (4). En lesiones grandes son lobuladas debido a la presencia de nódulos de estroma proliferante revestido por epitelio, siendo su nombre un término griego que significa “como una hoja” (6). Puede presentarse con áreas de necrosis, degeneración quística y hemorragia. Muchos tumores phyllodes son grandes y muchos alcanzan grandes dimensiones de más de 20 cm y otros menores de 5 cm. Microscópicamente, los tumores phyllodes presentan un estroma hipercelular y elementos glandulares benignos como un componente integral de un tumor. La apariencia y la cantidad de componente estromal determinan su diagnóstico diferencial con los fibroadenomas (6). Se ha clasificado en 3 categorías, benigno, borderline y maligno de acuerdo a parámetros histológicos que se enfocan en las características estromales de atipia, mitosis, hipercelularidad, sobrecrecimiento y la naturaleza de los márgenes, con distribución porcentual variada entre cada uno de estos subtipos, siendo el benigno el más común entre todos con una distribución de 58 % a 72 %, 12 %-18 %, 9 %-36 % respectivamente según los estudios nacionales e internacionales (1,5,7,9). Diferenciar entre las formas benignas y malignas no es siempre posible y más en las biopsias con aguja gruesa, originándose la necesidad de categorizar a los borderline (10), haciendo énfasis en las características estromales porque representa el componente neoplásico de progresión y es responsable de su comportamiento clínico (1, 11-15). Igualmente importante y llamativo es el reconocimiento de las interacciones epitelio estromales, aún en estudio, que juegan un papel importante en la patogénesis de estos tumores (16-18).
Del 10 % al 40 % de los tumores phyllodes tienen un comportamiento biológico maligno con tendencia a la recurrencia local y a la diseminación generalizada. Esto ha planteado la necesidad de clasificar y brindar una medida pronóstica para estos tumores raros, que han significado problemas en el manejo médico debido a su poca frecuencia y a lo contradictorio de los resultados en los diferentes trabajos de investigación realizados hasta ahora (19-21).
El objetivo del presente estudio es analizar el comportamiento clínico de una serie de casos de pacientes con tumor phyllodes, para determinar los factores clínicos y patológicos que influyen en la supervivencia global y libre de recurrencia de esta enfermedad.
Método
Es un estudio descriptivo analítico, donde se evaluaron los datos clínicos y anatomo-patológicos de las pacientes desde enero de 2001 hasta abril de 2011 con diagnóstico de tumor phyllodes de mama. En este período se reportaron 73 casos. Dentro de este grupo se excluyeron 13 casos de los cuales no se pudieron obtener las historias clínicas, por lo que el total de casos se redujo a 60, 18 pacientes fueron excluidos por datos incompletos, imprecisos y que no acudieron a los controles sucesivos de seguimiento, siendo cuarenta y dos (N=42) casos los que cumplieron con los criterios de inclusión, para nuestra población de estudio.
Se obtuvieron datos demográficos, clínicos e histopatológicos, que incluyeron edad al momento del diagnóstico, sexo, las fechas correspondientes al ingreso a nuestra institución, el diagnóstico histopatológico, cirugía, recurrencia, muerte, así como el tipo de cirugía realizada, período de seguimiento, el resultado del tratamiento y el tiempo de seguimiento.
Las variables patológicas y quirúrgicas fueron investigadas como predictores de recurrencia y supervivencia global. Se realizaron 4 tipos de cirugía (mastectomía total simple, mastectomía parcial, mastectomía radical modificada y mastectomía parcial oncológica) dependiendo del tamaño tumoral, compromiso de los márgenes y la preferencia del cirujano. La recurrencia local comprende todas aquellas lesiones que reaparecieron comprometiendo a la mama, la pared torácica y/o la axila, así como el lecho tumoral, y el resto como metástasis a distancia. Todas las biopsias fueron revisadas en el servicio de anatomía patológica con láminas teñidas con hematoxilina-eosina y los datos histopatológicos fueron obtenidos de los reportes macroscópicos y microscópicos, incluyendo la hipercelularidad, el pleomorfismo, el contaje mitótico, la atipia, los márgenes y el tamaño, clasificándolos en benignos, borderline y malignos.
Para el análisis estadístico, se calculó la media y la desviación estándar de las variables continuas; en el caso de las variables nominales se calcularon sus frecuencias y porcentajes. Se elaboraron curvas de supervivencia según el procedimiento no paramétrico de Kaplan Meier; las curvas fueron comparadas por el test log-rank. Se consideró un valor significativo de contraste si P < 0,05. Los datos se analizaron con SPSS 18.
Resultados
Todas las 42 pacientes evaluadas fueron mujeres. La edad al momento del diagnóstico comprendía entre los 16 y 66 años con una mediana de 41 años. Histológicamente se reportaron 42 tumores phyllodes; 23 fueron benignos, 11 borderline y 8 malignos. El tamaño tumoral estuvo entre 2 cm y 50 cm. Todos los casos fueron resecados por cuatro procedimientos quirúrgicos descritos en el Cuadro 1.
La media de seguimiento de estos pacientes fue de 82 meses, entre un rango de 9 a 163 meses, en los que se reportaron 6 casos de recurrencia, 3 en tumores benignos (13 %), 1 en borderline (9 %) y 2 de tumores malignos (22,2.%). Los márgenes estuvieron comprometidos en 4 pacientes correspondientes a 1 benigno, 2 borderline y 1 maligno.
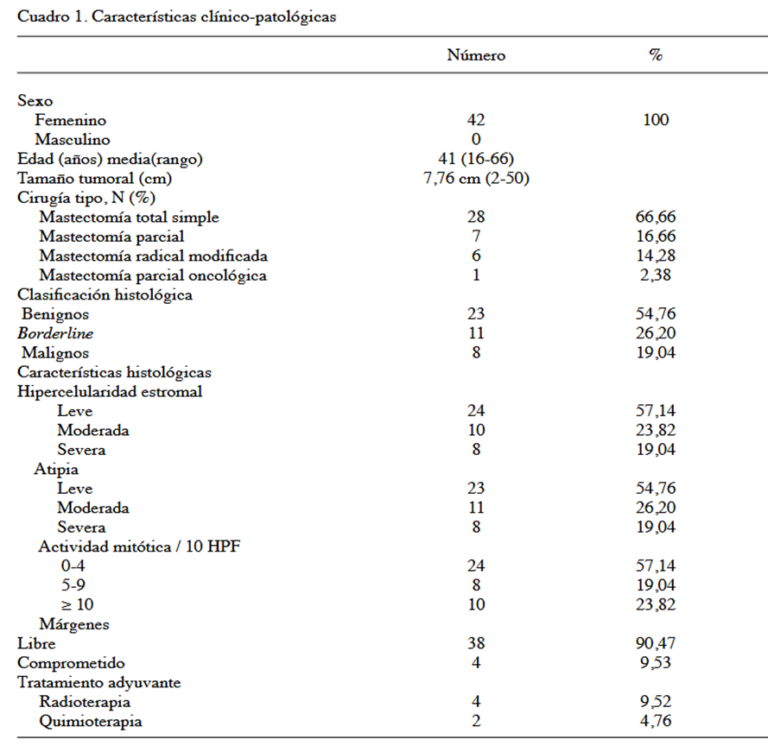
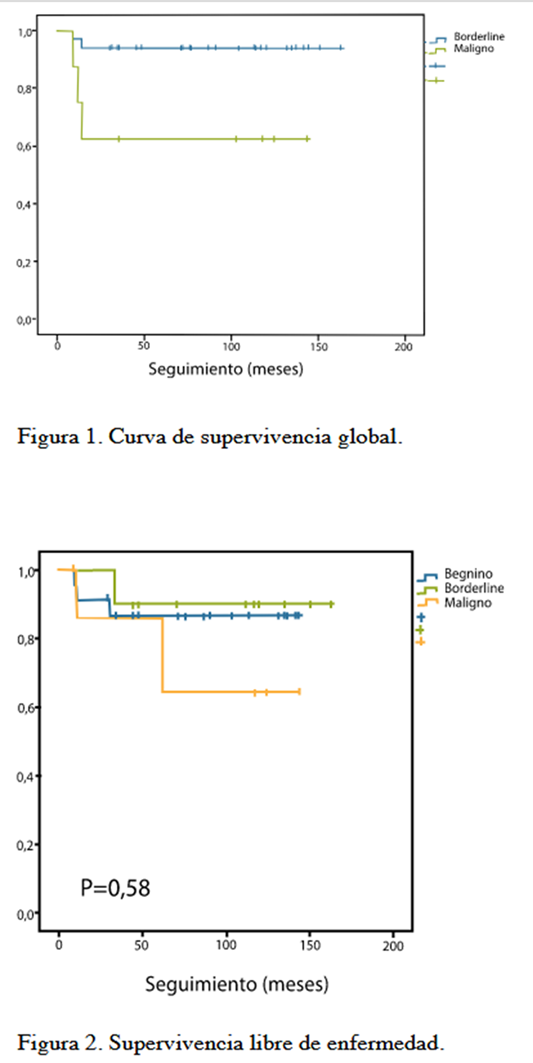
En cuanto a la supervivencia global según el grado histológico tumor, se pudo evidenciar que fue mayor en los pacientes con enfermedad benigna y borderline en comparación con los tumores malignos (P=0,011) con un valor de 88,1 % (Figura 1). Resultados similares fueron obtenidos respecto a la supervivencia libre de enfermedad a 5 años, siendo mayor en los pacientes con tumores benignos y borderline con un valor de 85,7 % (P=0,551) (Figura 2).
Discusión
El tumor phyllodes es una neoplasia rara de la mama que representa el 2 % al 3 % de todos los tumores fibroepiteliales y menos del 1 % de todos los tumores de mama (1, 6, 8,21). Independientemente del grado tumoral su tratamiento estándar es la cirugía con un amplio margen, preferiblemente mayor de un 1 cm para lograr el control local con menores tasas de recurrencia (22). Se ha utilizado como tratamiento adyuvante la radioterapia y la quimioterapia pero su uso no está muy claro actualmente. El uso de la terapia adyuvante como herramienta en el manejo del tumor phyllodes, está basada en una valoración individual multidisciplinaria tomando en cuenta los factores de riesgo en cada caso.
En nuestro estudio se realizó un seguimiento de 42 casos en un período de 10 años con una media de 82 meses, con la incidencia de 54,76 % de tumores benignos, 26,20 % de tumores borderline, y 19,04 % de tumores malignos, entre los 16 y 66 años con una media de 41 años como edad de presentación, coincidiendo con los datos presentados en múltiples publicaciones que oscilan entre un 40 % a un 60 % en los benignos, un 20 % a 40 % los borderline y de un 15 % al 30.% los tumores malignos (1,3,7,9). En Venezuela se realizó el reporte de 31 casos de tumor phyllodes con un seguimiento de aproximadamente 15 años en centro único (23), con una incidencia de 3,61 % de todos los tumores fibroepiteliales, representando similares porcentajes basándose en la hipercelularidad, pleomorfismo, contaje mitótico y atipia de la lesión (23).
El diagnóstico en nuestro estudio fue realizado en más del 95 % con biopsia con aguja gruesa (BAG) siendo el método diagnóstico de elección preoperatoria, porque se ha observado que en punción aguja fina (PAF), menos del 9 % nos dan el diagnóstico comparado con el 44 % de las BAG, con un poder predictivo negativo del 93 % y predictivo positivo del 83 % (24,25).
El fibroadenoma representa el diagnóstico diferencial de importancia. Las herramientas histológicas con la que contamos actualmente nos permiten diferenciar la existencia en primer lugar de una lesión fibroepitelial y una lesión epitelial. En segundo lugar, estos métodos permiten hasta cierto punto predecir el comportamiento biológico de la lesión fibro-epitelial que facilitará la selección de la mejor opción terapéutica quirúrgica para el paciente. Sin embargo, existen casos en los cuales una hipercelularidad estromal focal puede ser interpretada erróneamente, siendo el corte definitivo el que nos brindará el diagnóstico final de la biopsia. Los tumores phyllodes tienden a ser más grandes que los fibroadenomas con un margen de tamaño que puede variar de 1,5 cm a 28 cm según algunos reportes con una media de 7,4 cm (26,27). En nuestro estudio la media del tamaño tumoral fue de 7,76 cm en un rango de 2 cm a 50 cm.
En la histología de los tumores phyllodes se han determinado factores adversos como la hipercelularidad estromal severa, la atipia severa, la actividad mitótica mayor de 10 por campo de alto poder, con márgenes infiltrantes, así como márgenes quirúrgicos positivos o menores de 1 cm, son los determinantes de recurrencia tanto local como metastásica y de supervivencia global.
En la organización mundial de la salud (OMS) la tasa de recurrencia global de los tumores phyllodes fue del 21 %, por ello la importancia de clasificarlos en tumores benignos, borderline y malignos para determinar el riesgo a la recurrencia y a su vez la conducta a seguir. Se han demostrado tasas de recurrencias de 17 %, 25 % y 27 % respectivamente, con una supervivencia libre de recurrencia entre 54 % y 87 % (1, 3, 7, 9,28). En nuestro estudio solo hubo recurrencias locales, no metastásicas y la tasa de recurrencia se reportó en 13 %, 9 % y 22,2 % respectivamente con una supervivencia libre de recurrencia del 85,7.%. Estas recurrencias pueden ser determinadas según las características histológicas, como la hipercelularidad estromal, las atipias, mitosis y la naturaleza de los márgenes del tumor, que hacen su diferenciación en grados. A pesar de su valor estas características no nos pueden predecir el comportamiento individual de estos tumores, por ello se han creado nomogramas con la finalidad de conocer y calcular la supervivencia libre de recurrencia basados en 3 criterios histológicos y en el estado de los márgenes quirúrgicos, pudiendo ser aplicado para el manejo individual del paciente (1,29,30).
La supervivencia global en nuestro estudio fue reportada en 88,1 % (P=0,011), siendo de mejor pronóstico todos aquellos pacientes con tumores benignos y borderline con respecto a los malignos. En la actualidad se ha obtenido una supervivencia global que oscila entre 54 % a 82.% y 23 % a 42 % de 5 a 10 años respectivamente (1, 7, 26).
Se ha observado que la excisión total con un apropiado margen mayor a 1 cm y factores histológicos no adversos como la histopatología de los márgenes, proporciona al paciente la posibilidad de supervivencia libre de enfermedad y una herramienta importante al especialista para el manejo de las pacientes con tumores phyllodes y poder echar mano a las herramientas de la terapia adyuvante como radioterapia y quimioterapia, cuando se amerite, pero actualmente no se ha logrado encontrar el beneficio estadísticamente significativo de su utilización, por ello la recomendación en el uso individual de estos recursos (31-33).
En conclusión nuestro estudio reproduce las características y el comportamiento de los tumores phyllodes en nuestra población comparados con los resultados descritos en la literatura internacional. La determinación clínico-histológica nos permite no solo caracterizarlos sino establecer su comportamiento en la supervivencia global y libre de enfermedad. Es necesario hacer estudios de biología molecular y ploidía de estos tumores para encontrar los índices, que en el futuro permitan seleccionar de manera más asertiva el tratamiento más eficaz para los pacientes. Por último, nunca sobra la insistencia de los programa de pesquisa que permitan resecar tumores de menor tamaño que serán de mejor manejo y pronóstico.
Referencias
- Tan PH, Thike AA, Tan WJ, Thu MM, Busmanis I, Li H, et al. Predicting clinical behaviour of breast phyllodes tumours: A nomogram based on histological criteria and surgical margins. J Clin Pathol. 2012; 65(1):69-76.
- Muller J. Uber Den FeinernBau Und Die Formen Der Krankhaften Geschwulste. Berlin: G Reimer; 1838.
- Geisler DP, Boyle MJ, Malnar KF, McGee JM, Nolen MC, Fortner SM, et al. Phyllodes tumors of the breast: A review of 32 cases. Am Surg. 2000; 66:360-366.
- Rosai J. En: Rosai J Ackerman V, editores. Surgical Pathology. 10a edición. Filadelfia: El Sevier Mosby; 2010.p.1659-1770.
- Tan PH, Jayabaskar T, Chuah KL, Lee HY, Tan Y, Hilmy M, et al. Phyllodes tumors of the breast: The role of pathologic parameters. Am J Clin Pathol. 2005; 123:529-540.
- Kumar V, Abbes AK, Aster JC. En: Robbins S, Cotran C, editores. Pathologic basis of disease, 8a edición. Filadelfia: Saunders Elsevier; 2011.p.1065-1095.
- Ben Hassouna J, Damak T, Gamoudi A, Chargui R, Khomsi F, Mahjoub S, et al. Phyllodes tumors of the breast: A case series of 106 patients. Am J Surg. 2006; 192(2):141-147.
- Mora AE, Beteta JA, Russo M, Chargui R, Khomsi F, Mahjoub S, et al. Tumor phyllodes de la mama. Casuística de 15 años. Rev Venez Oncol. 2001;25(2):62-69.
- Lin CC, Chang HW, Lin CY, Chiu CF, Yeh SP. The clinical features and prognosis of phyllodes tumors: A single institution experience in Taiwan. Int J Clin Oncol. 2013;18(4):614-620.
- Azzopardi JG. En: Azzopardi J, editor. Sarcoma of the breast. Filadelfia: WB Saunders Co; 1979.p.355-339.
- Sawyer EJ, Poulsom R, Hunt FT, Jeffery R, Elia G, Ellis IO, et al. Malignant phyllodes tumors show stromal overexpression of c-my and c-kit. J Pathol. 2003; 200 (1):59-64.
- Sawyer EJ, Hamby AM, Ellis P, Lakhani SR, Ellis IO, Boyle S, et al. Molecular analysis of phyllodes tumors reveals distinct changes in the epithelial and stromal components. Am J Pathol. 2000; 156:1093-1098.
- Jones AM, Mitter R, Springall R, Graham T, Winter E, Gillett C, et al. Phyllodes Tumour Consortium. A comprehensive genetic profile of phyllodes tumours of the breast detects important mutations, intra-tumoral genetic heterogeneity and new genetic changes on recurrence. J Pathol. 2008; 214(5):533-544.
- Jones AM, Mitter R, Poulsom R, Gillett C, Hanby AM, Tomlinson IP, et al. mRNA expression profiling of phyllodes tumours of the breast: Identification of genes important in the development of borderline and malignant phyllodes tumours. J Pathol. 2008; 216:408-417.
- Jara-Lazaro AR, Tan PH. Molecular pathogenesis of progression and recurrence in breast phyllodes tumors. Am J Transl Res. 2009;1:23-34.
- Karim RZ, O’Toole SA, Scolyer RA. Recent insights into the molecular pathogenesis of mammary phyllodes tumors. J Clin Pathol. 2013;66(6):496-505.
- Kwon JE, Jung WH, Koo JS. Molecules involved in epithelial-mesenchymal transition and epithelial-stromal interaction in phyllodes tumors: Implications for histologic grade and prognosis. Tumour Biol. 2012;33(3):787-798.
- Karim RZ, Gerega SK, Yang YH, Horvath L, Spillane A, Carmalt H, et al. Proteins from the Wnt pathway are involved in the pathogenesis and progression of mammary phyllodes tumours. J Clin Pathol. 2009;62:1016-1020.
- Chaney AW, Pollack A, McNeese MD, Zagars GK, Pisters PW, Pollock RE, et al. Primary treatment of cystosarcoma phyllodes of the breast. Cancer. 2000;89(7):1502-1511.
- Rowell MD, Perry RR, Hsiu JG, Barranco SC. Phyllodes tumors. Am J Surg. 1993;165:376-379.
- Asoglu O, Ugurlu MM, Blanchard K, Grant CS, Reynolds C, Cha SS, et al. Risk factors for recurrence and death after primary surgical treatment of malignant phyllodes tumors. Ann Surg Oncol. 2004;11(11):1011-1017.
- Guillot E, Couturaud B, Reyal F, Curnier A, Ravinet J, Lae M, et al. Management of phyllodes breast tumors. Breast J. 2002;17(2):127-136.
- Mora A, Beteta J, Russo M, Reigosa A, Cobos M, Caleiras E, et al. Tumor Phyllodes de la mama. Casuística de 15 años. Rev Venez Oncol. 2001;13(4):150-155.
- Komenaka IK, El-Tamer M, Pile-Spellman E, Hibshoosh H. Core needle biopsy as a diagnostic tool to differentiate phyllodes tumor from fibroadenoma. Arch Surg. 2003;138:987-990.
- Gould D, Salmans JA, Lassinger BK, Contreras A, Gutierrez C, Bonefas E, et al. Factors associated with phyllodes tumor of the breast after core needle biopsy identifies fibroepithelial neoplasm. J Surg Res. 2012;178:299-303.
- Velazquez-Dohorn M, Gamboa-Dominguez A, Medina-Franco H. Phyllodes tumor of the breast: Clinic pathologic analysis of 22 cases. Rev Invest Clin. 2013;65 (3):214-220.
- Pimiento JM, Gadgil PV, Santillan AA, Lee MC, Esposito NN, Kiluk JV, et al. Phyllodes tumors: Race-related differences. J Am Coll Surg. 2011;213(4):537-542.
- Teo JY, Cheong CS, Wong CY. Low local recurrence rates in young Asian patients with phyllodes tumours: Less is more. ANZ J Surg. 2012;82(5):325-328.
- Taira N, Takabatake D, Aogi K, Ohsumi S, Takashima S, Nishimura R, et al. Phyllodes tumor of the breast: Stromal overgrowth and histological classification are useful prognosis-predictive factors for local recurrence in patients with a positive surgical margin. Jpn J Clin Oncol. 2007;37(10):730-736.
- Tan EY, Tan PH, Yong WS, Wong HB, Ho GH, Yeo AW, et al. Recurrent phyllodes tumors of the breast: Pathological features and clinical implications. ANZ J Surg. 2006;76(6):476-480.
- Barth RJ Jr, Wells WA, Mitchell SE, Cole BF. A prospective, multi-institutional study of adjuvant radiotherapy after resection of malignant phyllodes tumors. Ann Surg Oncol. 2009;16(8):2288-2294.
- Abdalla HM, Sakr MA. Predictive factors of local recurrence and survival following primary surgical treatment of phyllodes tumors of the breast. J Egypt Natl Canc Inst. 2006;18(2):125-133.
- Taira N, Takabatake D, Aogi K, Ohsumi S, Takashima S, Nishimura R, et al. Phyllodes tumor of the breast: Stromal overgrowth and histological classification are useful prognosis-predictive factors for local recurrence in patients with a positive surgical margin. Jpn J Clin Oncol. 2007;37(10):730-736.

