Neoadyuvancia en Cáncer Gástrico Avanzado; Factores Pronósticos de Respuesta Tumoral
Rev. Venez. Oncol. 2019;31(2):84-93
Por: Luis Galvis Contreras, Rafael Delgado Morales, Carmen Luces, Ignazio Taronna, Sol Pinto, Gustavo Gotera, Armando Gil Mendoza
Servicio De Patología Digestiva. Instituto De Oncología “Dr Luis Razetti”, Caracas, Venezuela
Resumen
OBJETIVO: El objetivo de este estudio es determinar los factores pronósticos que puedan predecir la respuesta tumoral a la quimioterapia neoadyuvante en el tratamiento de pacientes con cáncer gástrico avanzado. MÉTODO: El estudio es de tipo descriptivo, observacional y de carácter comparativo, se evaluaron los factores pronóstico de respuesta al tratamiento en pacientes con cáncer gástrico avanzado no metastásicos en el período 2002 a 2012, en el Instituto de Oncología “Dr. Luis Razetti ̈. RESULTADOS:Se obtuvieron 47 historias en las cuales se pudo apreciar que: edad menor a 60 años, tumores menores de 6 cm, lesiones de cuerpo gástrico y el estadio IIA, son factores pronósticos estadísticamente significativos para evaluar la respuesta tumoral al tratamiento neoadyuvante. La supervivencia global a 5 años fue de 43,9 % en pacientes operados con resecciones R0. CONCLUSIONES: Considerar factores pronósticos de respuesta tumoral a terapia neoadyuvante nos permite poder individualizar el tratamiento en pacientes de cáncer gástrico localmente avanzado. Se debe insistir en desarrollar estudios prospectivos donde se analicen estos factores pronósticos.
PALABRAS CLAVE: Cáncer gástrico, neoadyuvancia, supervivencia, factores pronósticos.
Introducción
El cáncer gástrico es el cuarto tumor más frecuente en el mundo y el tercer tumor con mayor morbilidad y mortalidad según los reportes mundiales de GLOBOCAN 2012. En las estadísticas 2018 de EE.UU la tasa de muerte por cada 100 000 habitantes oscila entre 2,3 a 4,3 en todas las poblaciones (1,2). El cáncer gástrico representa un problema de salud pública en el mundo, y nuestro país no escapa a esta situación. En Venezuela como en la mayoría de los países occidentales casi la totalidad de los pacientes con cáncer gástrico se presentan en forma avanzada y metastásicas.
El uso de la quimioterapia neoadyuvante ha sido aprobado como tratamiento inicial del tumor localmente avanzado con el objetivo de reducir la carga tumoral, la enfermedad metastásica oculta, así como observar la quimio sensibilidad del tumor “en vivo” y de esta forma permitir mayores porcentajes de resección R0, así como el aumento de la supervivencia. Los estudios aleatorizados iniciales que validaron esta modalidad terapéutica fueron el MAGIC, ACCORD-07 y EORTC 40954, en donde se compararon pacientes con cáncer gástrico avanzado tratados con quimioterapia perioperatoria, con pacientes tratados solo con cirugía, en ambos estudios se observó supervivencia global y libre de enfermedad favorable para el grupo de quimioterapia (4-6). En estudios posteriores de verificación se han reportado tasas R0 hasta 93 % con supervivencia global a 5 años hasta 52 %, en pacientes que se realizan gastrectomía posterior a quimioterapia neoadyuvante (7). La quimioterapia neoadyuvante ha podido consolidarse como principal modalidad terapéutica en pacientes con cáncer gástrico localmente avanzado en el mundo occidental (8).
Un inconveniente a la quimioterapia neoadyuvante es un porcentaje de respuesta tumoral muy variable que va entre el 20 % y 40.% en las diferentes series, esto crea un grupo de pacientes sin respuesta o progresión de la enfermedad, llevando a un mal pronóstico por el hecho de tener tumores no respondedores y a una disminución de la tasa de resección R0 (9). Los factores clínicos, patológicos y moleculares han sido estudiados en su influencia sobre la supervivencia global en pacientes con cáncer gástrico localmente avanzado, como herramienta para predecir su respuesta en la quimioterapia neoadyuvante se han publicado de forma aislada, por lo que actualmente, todavía, no existe información clara al respecto.
Existe un sistema de puntaje para determinar qué pacientes tienen más posibilidades de recurrencia en comparación de otros basado en factores clínico-patológicos con una sensibilidad del 83,5 % y una especificidad del 81,1 %, superando al sistema TNM de estadificación de la “International Union Cancer Control’s” (UICC), para predecir recurrencias (9).
Con respecto a los factores predictivos y pronósticos que pudieran influir en la respuesta a la quimioterapia neoadyuvante, las variables clínico-patológicas han sido descritas, algunas de ellas son el nivel de hemoglobina, presencia de ganglios comprometidosprevio al inicio de la terapia neoadyuvante, el tipo histológico, el estadio basado en la clasificación TNM, localización del tumor, el sexo y la edad, entre los más importantes, han dado en algunos casos resultados contradictorios y no concluyentes por basarse en estudios con pocos números de pacientes y bajo nivel de evidencia (10,11).
Los estudios de imágenes también han sido descritos como predictores de respuesta tumoral, entre ellos se describen la eco-endoscopia, la tomografía, la resonancia magnética y la tomografía con emisión de positrones. La tomografía por emisión de positrones (PET) entre el más destacado de esta modalidad, ha sido utilizado para predecir la respuesta a la quimioterapia preoperatoria en pacientes con tumores gástricos, tal como se mide por una disminución en el valor de captación de glucosa estándar del tumor (SUV) observada luego de la quimioterapia, correlacionándose bien con la respuesta clínica, patológica y supervivenciaen estudios iniciales (12-16).
Se han descrito varios marcadores moleculares que pudieran predecir la capacidad de respuesta a la quimioterapia neoadyuvante, como Glutatión-S-transferasa (GST), Dihydropyrimidinadehidrogenasa (DPD), TP y/o GADD45A, Excisionrepaircross-complementing1 (ERCC1), pérdida alélica fraccional (FAL), Let-7i, Lin28 y proteína asociada a la muerte-3 (DAP-3), ellos son utilizados actualmente a nivel mundial como método auxiliar para seleccionar terapias más específicas o personalizadas a los pacientes oncológicos (9).
Se han descrito criterios de respuesta histológicas a la quimioterapia neoadyuvante, la utilidad actual más que estandarizar la tasa de regresión a través de una escala, es predecir los resultados oncológicos en pacientes con cáncer gástrico. Las escalas más utilizadas son Mandard, Ninomiya y la escala de Becker, ellas analizan la cantidad de células tumorales, grado de necrosis y fibrosis en el espécimen quirúrgico, clasificándolos según un sistema de puntaje propio; se ha determinado que la escala de Becker es la más reproducible y aceptada por varios grupos de trabajo, en esta se divide la respuesta tumoral en 3 categorías midiendo la cantidad de células tumorales residuales con porcentajes, menores al 10 %, entre 10 %-50 % y más del 50 % (9,17-19).
El objetivo de este estudio es determinar los factores pronósticos que influyen en la regresión del tumor y operatividad de los pacientes con cáncer gástrico localmente avanzado que recibieron quimioterapia neoadyuvante así como su influencia en supervivencia global y supervivencia libre de enfermedad en el Instituto de Oncología “Dr. Luis Razetti” durante el período 2002-2012.
Método
El estudio es de tipo descriptivo, observacional y de carácter comparativo. La población en estudio está constituida por pacientes con diagnóstico de cáncer gástrico localmente avanzado que asistieron al servicio de vías digestivas del Instituto de Oncología “Dr. Luis Razetti” (IOLR) en el período 2002-2012; el número de historia fue localizado por el registro de tumores del servicio de anatomía patológica, y se seleccionaron para el estudio los pacientes que cumplían estrictamente con los siguientes criterios:
Criterios de inclusión
Pacientes de sexo femenino y masculino, con diagnóstico histopatológico de adenocarcinoma gástrico localmente avanzado, que no incluyan la unión esófago-gástrica, los estadios IIA, IIB, IIIA, IIIB, IIIC, irresecable por estudios de imágenes o por laparotomía exploradora, sin evidencia de enfermedad metastásica o segundos primarios, sin importar edad del diagnóstico.
Criterios de exclusión
Se excluyeron los pacientes con enfermedad en la unión esófago-gástrica, resecable, metastásica y que no hayan recibido quimioterapia neoadyuvante.
En el presente estudio se evaluaron las características demográficas, manifestaciones clínicas y características propias de la lesión que influyeron en la respuesta de la quimioterapia neoadyuvante en pacientes con cáncer gástrico localmente avanzado. Igualmente se determinó la resecabilidad de los pacientes luego de la neoadyuvancia, el número de resecciones R0 y los resultados oncológicos entre pacientes operados y no operados. Se define supervivencia global como el tiempo transcurrido entre el día de revisión de biopsias por nuestra institución, en el momento de la admisión, hasta el día de la muerte.
Procedimiento
El instrumento principal fue la historia clínica que permitió conocer el diagnóstico, estadificación del paciente y los datos de las variables ya mencionadas. Una vez seleccionados los pacientes se procedió a llenar la hoja de recolección de datos para su posterior análisis estadístico. Se usó el sistema CONSORT para la estructuración de las historias y delimitación de los pacientes a estudiar, bajo los criterios de inclusión y exclusión ya mencionados (Figura 1).
Análisis estadístico
Se calculó la media y la desviación estándar de las variables continuas, en el caso de las variables nominales, se calcularon sus frecuencias y porcentajes. La comparación de variables continuas entre operados y no operados se realizó con la prueba t de Student para muestras independientes. En el caso de variables nominales se aplicó la prueba Chi-2 de Pearson. La estimación de sobrevida se basó en el modelo no paramétrico de Kaplan-Meier y la comparación de las curvas de sobrevida se basó en la prueba logaritmo rango. Se consideró un valor estadísticamente significativo si P < 0,05. Los datos fueron analizados con SPSS 24.
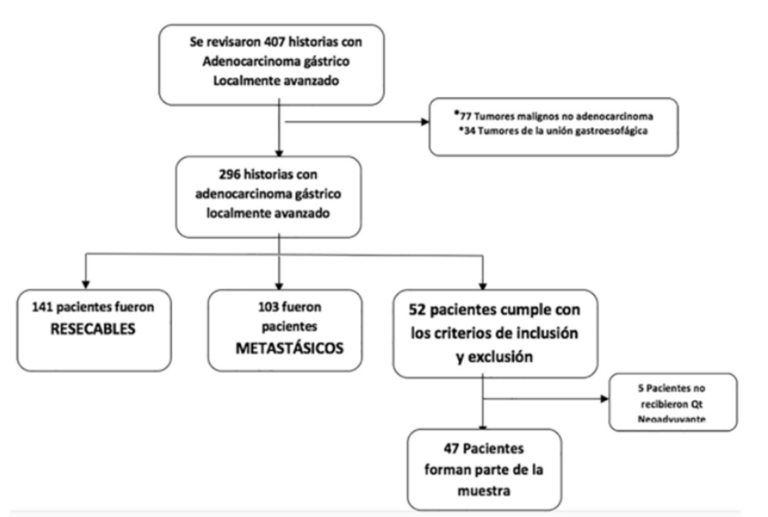
Resultados
De los 47 pacientes evaluados, 30 no se pudieron operar y 17 lograron operarse. En el Cuadro 1 se aprecian las características clínico patológicas de cada grupo de estudio, la mediana de edad de ambos grupos fue de 62 años. Cada grupo tiene características clínico-patológicas similares, excepto por la edad donde se evidenció diferencia estadísticamente significativa, con medianas de 58 años y 64 años para el grupo de operados y no operados respectivamente, con un P=0,033, siendo operable la población más joven. La población masculina prevaleció en total con un 57,4 %.
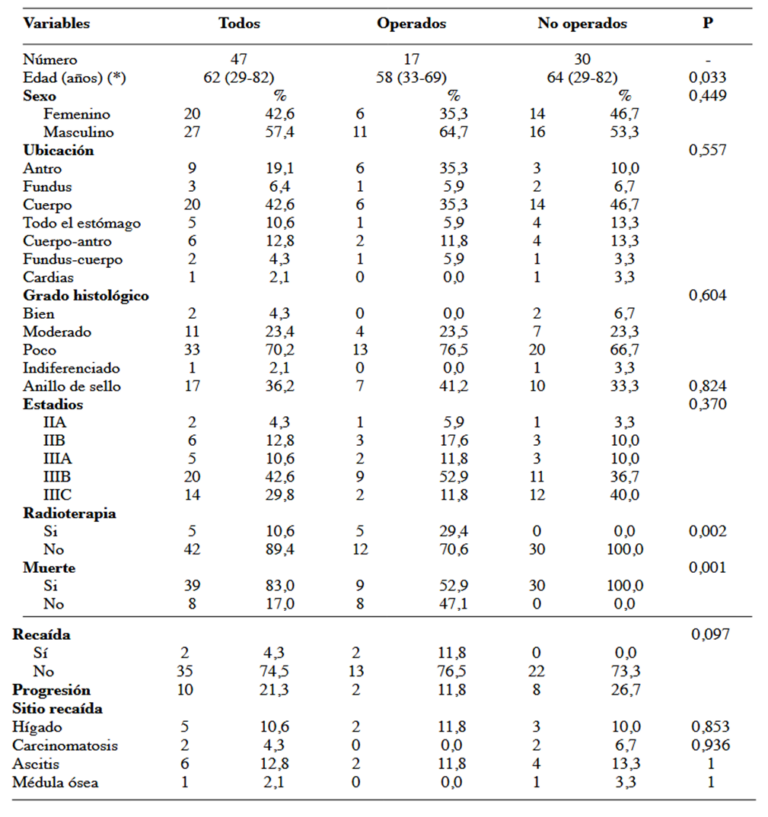
Al realizar el análisis estadístico univariado y multivariado se pudo determinar que el 80,8 % de los pacientes menores de 60 años responden al tratamiento neoadyuvante y por lo tanto aumentan 4,2 veces la posibilidad de ser operados. Considerando la variable tamaño tumoral, de los pacientes con tumores mayores de 6 cm, el 76,9 % no responden de manera favorable al tratamiento neoadyuvante y por lo tanto disminuyen 0,30 veces la posibilidad de ser operados, en lo referente a la localización tumoral, el 44,8 % de los pacientes con tumores en cuerpo gástrico responden a la quimioterapia y por lo tanto disminuyen 0,81 veces la posibilidad de ser operados. El 65,2 % de los pacientes con estadio IIA responden a la quimioterapia neoadyuvante y por lo tanto aumentan 1,87 veces la posibilidad de ser operados. Finalmente observamos que el 73,5 % de los pacientes que son operados sobreviven a la enfermedad localmente avanzada siendo un factor protector disminuyendo en 0,36 la probabilidad de muerte (Cuadro 2 y 3).
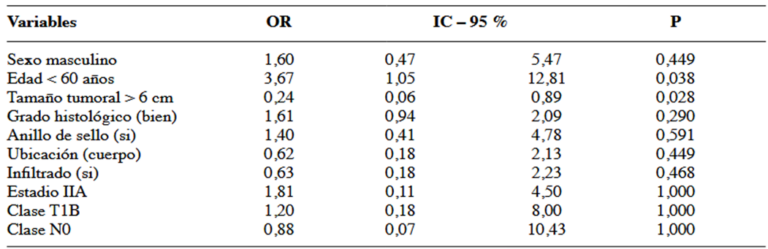
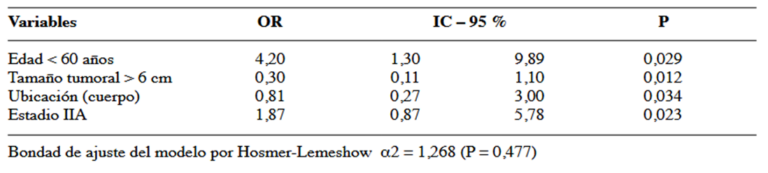
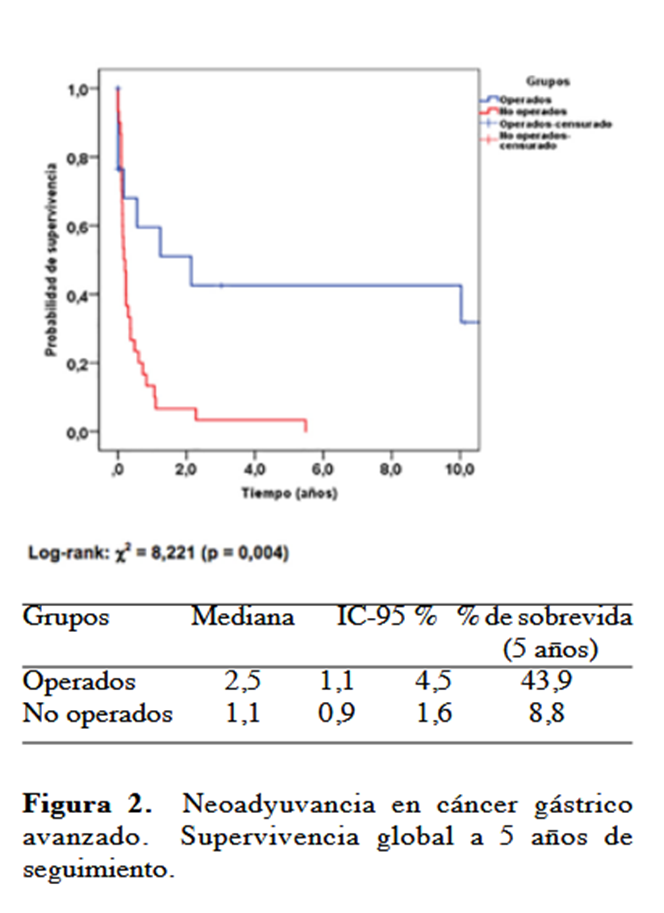
Mediante el análisis de la curva Kaplan Meier, se evidenció una diferencia estadísticamente significativa en la supervivencia global entre el grupo de pacientes operados y no operados con una P=0,004, determinando la supervivencia global en 43,9 % a 5 años (Figura 2).
Discusión
El cáncer gástrico es la segunda causa de muerte por cáncer en el mundo, ocasionando aproximadamente 989 600 nuevos casos con 738 000 muertes por año a nivel mundial. La incidencia de cáncer gástrico tiene una amplia variación según la zona geográfica, los países asiáticos y del este europeo son los de mayor incidencia. En Venezuela, la segunda causa de muerte está constituida por el cáncer, con el 15,61 % según el último anuario de mortalidad publicado, el grupo de tumores malignos del tubo digestivo con el 4,27 % representa el grupo más frecuente. Aunque esta neoplasia ha sido desplazada del primer lugar en mortalidad por el cáncer de pulmón y próstata en varones y por el cáncer de mama, cuello uterino, y pulmón en mujeres; se mantiene como una enfermedad de alta morbimortalidad, porque en la mayoría de los casos se diagnostican en etapas avanzadas (20,21).
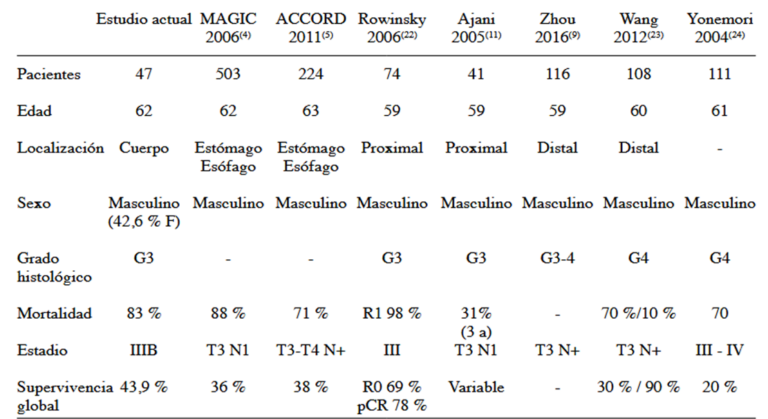
Al comparar nuestra revisión con otros estudios internacionales de terapia neoadyuvante, pudimos observar que el promedio de edad fue de 62 años, el cual estuvo acorde con los ensayos aleatorizados MAGIC y ACCORD-07 (4,5), que fueron de 62 y 63 años respectivamente. El porcentaje de pacientes femeninos de nuestro estudio fue de 42,6 %, mucho mayor del registrado en las diferentes publicaciones, en donde no superan un tercio de las diferentes muestras. La procedencia no se puede comparar en vista que no hay estudios venezolanos que lo especifiquen (Cuadro 4).
En las diferentes series publicadas, los adenocarcinomas gástricos se ubican entre el 37% al 60 % en el estómago distal, sin embargo, en las últimas décadas las lesiones se han hecho cada vez más proximales, en nuestro estudio, el 42 % de los pacientes sometidos a neoadyuvancia fueron en cuerpo gástrico y luego en antro, con el 19,1 %. El grado histológico más común involucrado fue el poco diferenciado con el 70,2 %, y este patrón se repite en todos los ensayos y meta análisis evaluados, con un porcentaje similar de presencia de anillo de sello asociados al tumor. La mortalidad fue del 83 % en un período de 10 años aproximadamente, más elevada en nuestra revisión, sin embargo, hay que considerar que los pacientes evaluados en nuestra serie presentaban enfermedad considerada irresecable no metastásica en estudios de imágenes o por laparotomía exploradora (26).
Los factores pronósticos que predicen la respuesta a la quimioterapia neoadyuvante han sido ampliamente descritos por Zhou y col. (9), entre ellos mencionan: 1. Evaluación histológica (escalas de respuesta Mandard, Ninomiyay o Becker), 2. Factores clínicos patológicos (edad, hemoglobina previa al tratamiento, estatus de los ganglios, localización, tamaño, grado histológico, nivel sérico de LDL, entre otros), 3. Los estudios de imagen y 4. Los marcadores genéticos tumorales. Con respecto a la edad se ha observado en múltiples metaanálisis y estudios prospectivos con excepción del grupo de Wang y col., los pacientes menores de 60 años tienen mayor tasa de respuesta al tratamiento y mayor posibilidad de ser operados, datos similares de nuestra revisión (23).
El tamaño del tumor es un factor predictor independiente de la regresión del tumor, donde se establece el tamaño de más o menos de 6 cm como parámetro base, en nuestro estudio apenas el 23,1 % de los pacientes con tumores mayores de 6 cm pudieron ser operados, evidenciando estadísticamente que existe mayor porcentaje de regresión en pacientes con tumores menores de 6 cm. En el presente estudio se registró que el mayor porcentaje de pacientes eran de cuerpo gástrico y por ende el 44,8 % de los pacientes respondieron a la quimioterapia neoadyuvante, pudiéndose operar, pero no se pudo determinar que fuera un predictor independiente de regresión y respuesta patológica tumoral. Ajani y col. (11), determinaron que no hay un único factor clínico que puedan predecir la respuesta patológica completa o parcial del tumor gástrico localmente avanzado, ellos también concluyeron que el estatus posquirúrgico con resecciones R0 era la variable de mayor peso para predecir la supervivencia global y libre de enfermedad que el mismo estatus preoperatorio. Los resultados oncológicos en nuestros datos mostraron una diferencia estadísticamente significativa en la supervivencia global entre el grupo de pacientes operados y no operados con una P=0,004, determinando la supervivencia global a 5 años en 43,9 %, datos similares en el estudio de Ajani (Cuadro 4).
En conclusión, entre los pacientes con cáncer gástrico localmente avanzado que fueron a tratamiento neoadyuvante se pudo destacar que la edad menor a 60 años, los tumores menores de 6 cm, los tumores de cuerpo gástrico y el estadio IIA, son factores pronósticos estadísticamente significativos que pueden predecir una respuesta tumoral adecuada a la quimioterapia, y de esta forma aumentar la probabilidad de realizar resecciones R0, y así obtener mejores resultados oncológicos. Es de considerar la realización de estudios prospectivos más amplios que logren determinar factores con mayor fuerza estadística que puedan predecir la respuesta a la quimioterapia neoadyuvante en los pacientes de cáncer gástrico localmente avanzado.
Referencias
1. Ferlay J, Soerjomataram I, Dikshit R, Eser S, Mathers C, Rebelo M, et al. Cancer incidence and mortality worldwide: Sources, methods and major patterns in GLOBOCAN 2012. Int J Cancer. 2015;136:E359-386.
2. Siegel RL, Miller KD, Jemal A. Cancer statistics, 2018. CA Cancer J Clin. 2018;68:7-30.
3. D’Angelica M, Gonen M, Brennan MF, Turnbull AD, Bains M, Karpeh MS. Patterns of initial recurrence in completely resected gastric adenocarcinoma. Ann Surg. 2004;240:808-816.
4. Cunningham D, Allum WH, Stenning SP, Thompson JN, Van de Velde CJ, Nicolson M, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med. 2006;355(1):11-20.
5. Ychou M, Boige V, Pignon JP, Conroy T, Bouché O, Lebreton G, et al. Perioperative chemotherapy compared with surgery alone for resectable gastroesophageal adenocarcinoma: An FNCLCC and FFCD multicenter phase III trial. J Clin Oncol. 2011;29(13):1715-1721.
6. Schuhmacher C, Gretschel S, Lordick F, Reichardt P, Hohenberger W, Eisenberger CF, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of stomach and cardias. EORTC. European Organization for Research and Treatment of Cancer randomized trial 40954. J Clin Oncol. 2010;28:5210-5218.
7. Badgwell B, Blum M, Estrella J, Chiang YJ, Das P, Matamoros A, et al. Predictors of survival in patients with resectable gastric cancer treated with preoperative chemo radiation therapy and gastrectomy. J Am Coll Surg. 2015;221(1):83-90.
8. Karagkounis G, Squires MH 3rd, Melis M, Poultsides GA, Worhunsky D, Jin LX, et al. Predictors and prognostic implications of perioperative chemotherapy completion in gastric cancer. J Gastrointest Surg. 2017;21(12):1984-1992.
9. Zhou J, Shen J, Seifer BJ, Jiang S, Wang J, Xiong H, et al. Approaches and genetic determinants in predicting response to neoadjuvant chemotherapy in locally advanced gastric cancer. Oncotarget. 2017;8(18):30477-30494.
10. Yonemori K, Shimada Y, Goto A, Ura T, Arai T, Hamaguchi T, et al. Retrospective analysis of clinical results and predictors of response in chemo-naive patients with advanced gastric cancer treated with S-1, an oral fluoropyrimidine derivative, as single agent chemotherapy. Gastric Cancer. 2004;7:204-210.
11. Ajani JA, Mansfield PF, Crane CH, Wu TT, Lunagomez S, Lynch PM, et al. Paclitaxel-based chemo-radiotherapy in localized gastric carcinoma: Degree of pathologic response and not clinical parameters dictated patient outcome. J Clin Oncol. 2005;23:1237-1244.
12. Lordick F, Ott K, Krause BJ, Weber WA, Becker K, Stein HJ, et al. PET to assess early metabolic response and to guide treatment of adenocarcinoma of the esophagogastric junction: The MUNICON phase II trial. Lancet Oncol. 2007;(9):797-805.
13. zum Büschenfelde CM, Herrmann K, Schuster T, Geinitz H, Langer R, Becker K, et al. (18)F-FDG PET-guided salvage neoadjuvant radio-chemotherapy of adenocarcinoma of the esophagus-gastric junction: The MUNICON II trial. J Nucl Med. 2011;52(8):1189-1196.
14. Ang J, Hu L, Huang PT, Wu JX, Huang LN, Cao CH, Zheng YX, et al. Contrast-enhanced ultrasonography assessment of gastric cancer response to neoadjuvant chemotherapy. World J Gastroenterol. 2012;18(47):7026-7032.
15. Tang L, Li ZY, Li ZW, Zhang XP, Li YL, Li XT1, et al. Evaluating the response of gastric carcinomas to neoadjuvant chemotherapy using iodine concentration on spectral CT: A comparison with pathological regression. Clin Radiol. 2015;70(11):1198-1204.
16. Achilli P, De Martini P, Ceresoli M, Mari GM, Costanzi A, Maggioni D, et al. Tumor response evaluation after neoadjuvant chemotherapy in locally advanced gastric adenocarcinoma: A prospective, multi-center cohort study. J Gastrointest Oncol. 2017;8(6):1018-1025.
17. Becker K, Mueller JD, Schulmacher C, Ott K, Fink U, Busch R, et al. Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy. Cancer. 2003;98:1521-1530.
18. Ninomiya Y, Yanagisawa A, Kato Y, Kitagawa T, Ishihara S, Nakajima T. Histological indications of a favorable prognosis with far-advanced gastric carcinomas after preoperative chemotherapy. J Cancer Res Clin Oncol. 1999;125:699-706.
19. Mandard AM, Dalibard F, Mandard JC, Marnay J, Henry-Amar M, Petiot JF, et al. Pathologic assessment of tumor regression after preoperative chemoradiotherapy of esophageal carcinoma. Clinicopathologic correlations. Cancer. 1994;73:2680-2686.
20. [No author ́s list]. Cancer Incidence and Mortality World Wide: Disponible en: URL: http: //globocan.iarc.fr. Fecha de consulta:15/10/2012
21. Parra JF. Consideraciones sobre cáncer gástrico [disertación]. Caracas, Venezuela: Academia Nacional de Medicina; 2013.
22. Rowinsky EK, Donehower RC. Paclitaxel (taxol). N Engl J Med. 1995;332:1004-1014.
23. Wang LB, Teng RY, Jiang ZN, Hu WX, Dong MJ, Yuan XM, et al. Clinicopathologic variables predicting tumor response to neoadjuvant chemotherapy in patients with locally advanced gastric cancer. J Surg Oncol. 2012;105(3):293-296.
24. Yonemori K, Shimada Y, Goto A, Ura T, Arai T, Muro K, et al. Retrospective analysis of clinical results and predictors of response in chemo-naive patients with advanced gastric cancer treated with S-1, an oral fluoropyrimidine derivative, as single agent chemotherapy. Gastric Cancer. 2004;7:204-210.
25. Xu AM, Huang L, Liu W, Gao S, Han WX, Wei ZJ. Neoadjuvant chemotherapy followed by surgery versus surgery alone for gastric carcinoma: Systematic review and meta-analysis of randomized controlled trials. PLoS One. 2014;30;9(1):e86941
26. Greenleaf EK, Hollenbeak CS, Wong J. Trends in the use and impact of neoadjuvant chemotherapy on perioperative outcomes for resected gastric cancer: Evidence from the American College of Surgeons National Cancer Database. Surgery. 2016;159(4):1099-1112.

